En este blog hablaremos sobre la Estructura del Átomo, encontrarás la más completa información para tus trabajos, también habrá imágenes, gif, videos etc...
viernes, 2 de septiembre de 2016
Estructura Atómicas
Hasta fines del siglo XIX prevaleció la teoría de que la materia estaba formando por pequeñas partículas indivisibles e indestructibles llamada átomos. Sin embargo a partir de la última de la década del siglo XIX hasta la fecha se ha demostrado la existencia de más de 30 partículas subatómicas. De ellas las más importantes son: Newton, protón y el electrón (n, H+, e-)
- Protón (H+): tiene carga positiva y una unidad de masa atómica y se encuentra ubicado en el núcleo del átomo.
- Neutron (n): no tiene carga y tiene una unidad de masa atómica y se ubica en el núcleo.
- Electrón (e-): tiene carga negativa masa despreciable y se ubica en la zona externa del átomo.

Así se considera al átomo como una esfera prácticamente vacía, constituido por un núcleo central que tienen los protones positivos y los neutrones sin carga y prácticamente toda la masa del átomo.
Los electrones con carga negativa y masa despreciable se ubican en la nube electrónica que es el espacio entre el núcleo y la superficie externa del átomo.
Las propiedades físicas de la materia depende de la masa de los átomos (núcleo) y los químicos de los electrones externos.
La distribución de los electrones en la nube electrónica, no es arbitraria sino respetando leyes eléctricas y magnéticas. Estos lugares permitidos reciben el nombre de niveles de energía que se identifican con números enteros comenzando con el 1 y se refiere a la energía cinética del electrón.
Cada nivel de energía el electrón puede moverse en determinadas zonas llamadas orbitales atómicas (región del espacio que rodea el núcleo donde es máxima la probabilidad de encontrar al electrón)
Principio de Exclusión de Pauli - Regla de Hund
Según el Principio de Exclusión de Pauli cada orbital sólo puede ser ocupado por 2 electrones que giran en sentido contrario.
Regla de Hund
Por otra parte y de acuerdo a la Regla de Hund en un subnivel con diferentes orbitales, se debe ir llenando cada orbital con un sólo electrón y con el mismo Spin (mismo sentido de giro)
Así tenemos: 1 orbital S con 2 e-
3 orbitales P con 6-
5 orbitales D con 10 e-
7 orbitales F con 14 e-
Para poder comprender bien la regla de Hund, es necesario saber que todos los orbitales en una capa deben de encontrarse ocupados al menos por un electrón, antes de que se añada un segundo electrón. Es decir, los orbitales deben estar completos y todos los electrones deben encontrarse en paralelo antes de que el orbital se llene del todo. Cuando el orbital adquiera el segundo electrón, éste debe encontrarse apareado con el anterior.

Estructura Atómica - Configuración Electronica
¿Qué es la configuración electronica?
Es la distribución de los electrones en los distintos orbitales,consta de:un numero que me indica nivel de energía,una letra (s,p,d,f)que indica el tipo de orbital y por ultimo otro numero colocado como superíndice que corresponde a la cantidad de electrones que se ubican en el orbital. La Configuración o Distribución electrónica nos dice como están ordenados los electrones en los distintos niveles de energía (órbitas), o lo que es lo mismo como están distribuidos los electrones alrededor del núcleo de su átomo.
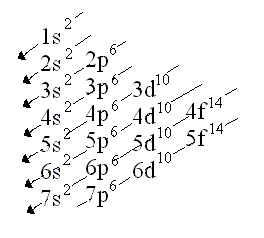
Ej: el hidrógeno tiene un electrón en el orbital s de la primera capa, de ahí que su configuración electrónica se escriba 1s1. El litio tiene dos electrones en la subcapa 1s y uno en la subcapa 2s (de mayor energía), de ahí que su configuración electrónica se escriba 1s2 2s1.
Aquí les dejamos un video con la explicacion de los ejercicios de la Configuración Electronica:
Ejercicios:
lunes, 29 de agosto de 2016
Rutherford
El modelo atómico de Rutherford es un modelo atómico o teoría sobre la estructura interna del átomo propuesto por el químico y físico británico-neozelandés Ernest Rutherford.

El modelo de Rutherford fue el primer modelo atómico que consideró al átomo formado por dos partes: la "corteza" (luego denominada periferia), constituida por todos sus electrones, girando a gran velocidad alrededor de un "núcleo" muy pequeño; que concentra toda la carga eléctrica positiva y casi toda la masa del átomo.
Rutherford llegó a la conclusión de que la masa del átomo se concentraba en una región pequeña de cargas positivas que impedían el paso de las partículas alfa. Sugirió un nuevo modelo en el cual el átomo poseía un núcleo o centro en el cual se concentra la masa y la carga positiva, y que en la zona extranuclear se encuentran los electrones de carga negativa.


 , es la energía cinética inicial de la partícula alfa incidente.
, es la energía cinética inicial de la partícula alfa incidente. es el parámetro de impacto
es el parámetro de impacto
Dado que Rutherford observó una fracción apreciable de partículas "rebotadas" para las cuales el ángulo de deflexión es cercano a χ ≈ π, de la relación inversa a:

se deduce que el parámetro de impacto debe ser bastante menor que el radio atómico. De hecho el parámetro de impacto necesario para obtener una fracción apreciable de partículas "rebotadas" sirvió para hacer una estimación del tamaño del núcleo atómico, que resulta ser unas cien mil veces más pequeño que el diámetro atómico. Este hecho resultó ser la capacidad uniformable sobre la carga positiva de neutrones.

El modelo de Rutherford fue el primer modelo atómico que consideró al átomo formado por dos partes: la "corteza" (luego denominada periferia), constituida por todos sus electrones, girando a gran velocidad alrededor de un "núcleo" muy pequeño; que concentra toda la carga eléctrica positiva y casi toda la masa del átomo.
Rutherford llegó a la conclusión de que la masa del átomo se concentraba en una región pequeña de cargas positivas que impedían el paso de las partículas alfa. Sugirió un nuevo modelo en el cual el átomo poseía un núcleo o centro en el cual se concentra la masa y la carga positiva, y que en la zona extranuclear se encuentran los electrones de carga negativa.

Antes de que Rutherford propusiera su modelo atómico, los físicos aceptaban que las cargas eléctricas en el átomo tenían una distribución más o menos uniforme. Rutherford trató de ver cómo era la dispersión de las partículas alfa por parte de los átomos de una lámina de oro muy delgada. Los ángulos resultantes de la desviación de las partículas supuestamente aportarían información sobre cómo era la distribución de carga en los átomos. Era de esperar que, si las cargas estaban distribuidas uniformemente según el modelo atómico de Thomson, la mayoría de las partículas atravesarían la delgada lámina sufriendo solo ligerísimas deflexiones, siguiendo una trayectoria aproximadamente recta. Aunque esto era cierto para la mayoría de las partículas alfa, un número importante de estas sufrían deflexiones de cerca de 180º, es decir, prácticamente salían rebotadas en dirección opuesta a la incidente.
Rutherford pensó que esta fracción de partículas rebotadas en dirección opuesta podía ser explicada si se suponía la existencia de fuertes concentraciones de carga positiva en el átomo. La mecánica newtoniana en conjunción con la ley de Coulomb predice que el ángulo de deflexión de una partícula alfa relativamente liviana por parte de un átomo de oro más pesado, depende del "parámetro de impacto" o distancia entre la trayectoria de la partícula y el núcleo:

 , es la energía cinética inicial de la partícula alfa incidente.
, es la energía cinética inicial de la partícula alfa incidente. es el parámetro de impacto
es el parámetro de impacto
Suscribirse a:
Entradas (Atom)





