En este blog hablaremos sobre la Estructura del Átomo, encontrarás la más completa información para tus trabajos, también habrá imágenes, gif, videos etc...
viernes, 2 de septiembre de 2016
Estructura Atómicas
Hasta fines del siglo XIX prevaleció la teoría de que la materia estaba formando por pequeñas partículas indivisibles e indestructibles llamada átomos. Sin embargo a partir de la última de la década del siglo XIX hasta la fecha se ha demostrado la existencia de más de 30 partículas subatómicas. De ellas las más importantes son: Newton, protón y el electrón (n, H+, e-)
- Protón (H+): tiene carga positiva y una unidad de masa atómica y se encuentra ubicado en el núcleo del átomo.
- Neutron (n): no tiene carga y tiene una unidad de masa atómica y se ubica en el núcleo.
- Electrón (e-): tiene carga negativa masa despreciable y se ubica en la zona externa del átomo.

Así se considera al átomo como una esfera prácticamente vacía, constituido por un núcleo central que tienen los protones positivos y los neutrones sin carga y prácticamente toda la masa del átomo.
Los electrones con carga negativa y masa despreciable se ubican en la nube electrónica que es el espacio entre el núcleo y la superficie externa del átomo.
Las propiedades físicas de la materia depende de la masa de los átomos (núcleo) y los químicos de los electrones externos.
La distribución de los electrones en la nube electrónica, no es arbitraria sino respetando leyes eléctricas y magnéticas. Estos lugares permitidos reciben el nombre de niveles de energía que se identifican con números enteros comenzando con el 1 y se refiere a la energía cinética del electrón.
Cada nivel de energía el electrón puede moverse en determinadas zonas llamadas orbitales atómicas (región del espacio que rodea el núcleo donde es máxima la probabilidad de encontrar al electrón)
Principio de Exclusión de Pauli - Regla de Hund
Según el Principio de Exclusión de Pauli cada orbital sólo puede ser ocupado por 2 electrones que giran en sentido contrario.
Regla de Hund
Por otra parte y de acuerdo a la Regla de Hund en un subnivel con diferentes orbitales, se debe ir llenando cada orbital con un sólo electrón y con el mismo Spin (mismo sentido de giro)
Así tenemos: 1 orbital S con 2 e-
3 orbitales P con 6-
5 orbitales D con 10 e-
7 orbitales F con 14 e-
Para poder comprender bien la regla de Hund, es necesario saber que todos los orbitales en una capa deben de encontrarse ocupados al menos por un electrón, antes de que se añada un segundo electrón. Es decir, los orbitales deben estar completos y todos los electrones deben encontrarse en paralelo antes de que el orbital se llene del todo. Cuando el orbital adquiera el segundo electrón, éste debe encontrarse apareado con el anterior.

Estructura Atómica - Configuración Electronica
¿Qué es la configuración electronica?
Es la distribución de los electrones en los distintos orbitales,consta de:un numero que me indica nivel de energía,una letra (s,p,d,f)que indica el tipo de orbital y por ultimo otro numero colocado como superíndice que corresponde a la cantidad de electrones que se ubican en el orbital. La Configuración o Distribución electrónica nos dice como están ordenados los electrones en los distintos niveles de energía (órbitas), o lo que es lo mismo como están distribuidos los electrones alrededor del núcleo de su átomo.
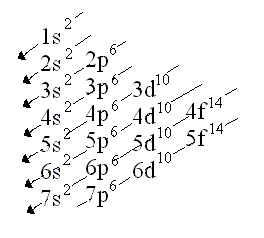
Ej: el hidrógeno tiene un electrón en el orbital s de la primera capa, de ahí que su configuración electrónica se escriba 1s1. El litio tiene dos electrones en la subcapa 1s y uno en la subcapa 2s (de mayor energía), de ahí que su configuración electrónica se escriba 1s2 2s1.
Aquí les dejamos un video con la explicacion de los ejercicios de la Configuración Electronica:
Ejercicios:
Suscribirse a:
Entradas (Atom)

